Nierenkrebs: Forscher enthüllen die Bedeutung des Erbguts
Nierentumoren liegen in Deutschland an sechster Stelle der Krebsneuerkrankungen bei Männern, an elfter Stelle bei Frauen. Die Tumorart ist vor allem im fortgeschrittenen Stadium durch eine hohe Sterblichkeit und nur sehr begrenzte Therapiemöglichkeiten gekennzeichnet. Die genauen Mechanismen, wie Nierentumoren entstehen und voranschreiten, sind bisher nur unzureichend geklärt. Wissenschaftler der Medizinischen Klinik 4 konnten nun im Rahmen eines von der Wilhelm Sander-Stiftung geförderten Forschungsprojektes zeigen, dass einzelne regulatorische Stellen im Erbgut des Menschen eine wichtige Rolle bei der Entstehung und dem Voranschreiten der Erkrankung spielen.
Nierenkrebs liegt häufig einen Gendefekt zugrunde
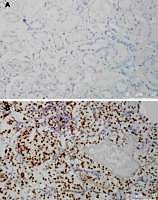
Ein Großteil der Nierentumorerkrankungen entsteht durch die Entartung einzelner Zellen im Bereich des Urin-produzierenden Systems der Nieren, dem sogenannten Nephron. Dieses setzt sich aus einem Nierenkörperchen und einer daran angeschlossen röhrenförmige Struktur, dem Tubulus, zusammen. Aus den Zellen des Tubulus entstehen die Nierentumoren. Risikofaktoren, die die Entstehung von Nierenkrebs begünstigen, sind unter anderem das Rauchen, einzelne Chemikalien und Nierenzysten. Ein kleiner Teil wird jedoch auch durch Erbkrankheiten, wie zum Beispiel die Von-Hippel-Lindau-Erkrankung (VHL), verursacht. Genauere Untersuchungen haben gezeigt, dass der Verlust des VHL-Proteins zur Stabilisierung von Proteinen führt, die eng mit der Zellantwort auf Sauerstoffmangel (Hypoxie) in Verbindung stehen. Diese Hypoxie-induzierbaren Transkriptionsfaktoren (HIF-1α und HIF-2α) sind Proteine, die mit der DNA interagieren und es der Zelle ermöglichen, durch veränderte Expression von Genen den Stoffwechsel an einen akuten Sauerstoffmangel anzupassen. Bei Nierentumoren kommt es aufgrund der Stabilisierung der HIF zu einer dauerhaften Aktivierung dieses „Notfallsystems“. Dadurch bekommen die Tumorzellen einen Überlebensvorteil. Umfassende Studien haben gezeigt, dass in den meisten Nierentumoren – also auch spontan entstandenen – ein Defekt im VHL-Gen vorliegt und das HIF-System aktiv ist (Abbildung). Dieses System scheint daher eine enorme Relevanz für die Biologie des Nierentumors zu haben.
In einer aktuellen Studie im Rahmen eines von der Wilhelm Sander-Stiftung geförderten Forschungsprojektes (sowie dank weiterer Förderung durch die Deutsche Forschungsgemeinschaft und die Else Kröner-Fresenius Stiftung) konnten Wissenschaftler der Medizinischen Klinik 4 unter der Leitung von PD Dr. Dr. Johannes Schödel in Kooperation mit Wissenschaftlern der Universität Oxford unter Leitung von Prof. Sir Peter Ratcliffe zeigen, wie die HIF mit der DNA der Zellen des Tubulussystems interagieren und die Entstehung von Nierentumoren beeinflussen. Der Kontakt zur DNA wird dabei stark durch genetische Variationen zwischen einzelnen Menschen beeinflusst. Einige dieser Variationen, also der Austausch einzelner DNA-Sequenzen, wurden bereits durch andere Arbeitsgruppen als relevant für die Entstehung von Nierentumoren identifiziert. Wie diese aber genau Einfluss auf die Krankheit nehmen, blieb unklar. Dr. J. Schödel und sein Team konnten nun zeigen, dass Risikovariationen für Nierenkrebs und Bindestellen der HIF in der DNA nicht zufällig übereinstimmen, sondern es einen statistisch signifikanten Zusammenhang gibt. Eine der Variationen liegt dabei auf dem Chromosom 12p12.1. Erst die Risikovariation ermöglicht es, dass HIF an die DNA in diesem Bereich binden können, vergleichbar mit einem Schlüssel-Schloss-Prinzip. Durch die Bindung von HIF kommt es zur verstärkten Expression des Proteins BHLH41. Die Ergebnisse der Studie deuten darauf hin, dass die vermehrte Bildung von BHLH41 vor allem in der frühen Phase der Entstehung von Nierenkrebs eine wichtige Rolle spielen könnte und den Tumorzellen einen Überlebensvorteil verschafft.
Die Forschungsgruppe konnte in weiteren Arbeiten zeigen, dass auch wichtige Onkogene – d. h. Proteine, die die Entstehung von Tumoren fördern – in Nierentumoren einer ähnlichen Regulation durch HIF unterliegen. Wichtig dabei ist, dass diese Mechanismen nur in den Zellen des Tubulussystems der Niere oder den Tumorzellen greifen und somit zelltypspezifisch sind.
Die gemeinsam veröffentlichten Studien können als beispielhaft für die zukünftige Aufarbeitung von Mechanismen der genetischen Veranlagung für die Krankheitsentstehung im Allgemeinen angesehen werden. Sie erklären, wie ein krankheitsrelevanter Faktor (HIF) durch unterschiedliche Bindung an krankheitsassoziierte, genetische Varianten die Entstehung von zelltypspezifischen Tumoren fördert.
Die Wilhelm Sander-Stiftung fördert Forschung zur Krebsbekämpfung
Die Wilhelm Sander-Stiftung hat dieses Forschungsprojekt mit rund 140.000 Euro unterstützt. Stiftungszweck ist die Förderung der medizinischen Forschung, insbesondere von Projekten im Rahmen der Krebsbekämpfung. Seit Gründung der Stiftung wurden insgesamt über 228 Millionen Euro für die Forschungsförderung in Deutschland und der Schweiz bewilligt. Damit ist die Wilhelm Sander-Stiftung eine der bedeutendsten privaten Forschungsstiftungen im deutschen Raum. Sie ging aus dem Nachlass des gleichnamigen Unternehmers hervor, der 1973 verstorben ist.
Weitere Informationen
PD Dr. Dr. Johannes Schödel
Tel: 09131-8539202 / Fax: 09131-8539561